本论文在硫酸介质中,铬(VI)对过氧化氢氧化孔雀石绿的褪色反应具有很明显的催化作用,根据这些建立了催化动力学光度法测定铬(VI)含量的新方法,用于测定废水中的微量铬(VI),获得了满意的结果。
1 实验部分
1.1 仪器和试剂
仪器:TU-1901双光束紫外可见分光光度计(北京普析通用仪器有限责任公司);S22PC可见分光光度计(上海棱光技术有限公司);AL204电子分析天平(上海梅特勒-托利多仪器(上海)有限公司);HH-S6恒温水浴锅(巩义市予华仪器有限责任公司)。
试剂:铬(VI)标准储备液:准确称取准确称取0.2829g重铬酸钾溶于水,于100mL容量瓶中定容,得质量浓度为铬(VI)1.00mg/L的储备液;Cr(VI)标准工作溶液:使用时用蒸馏水将铬(VI)的标准储备液稀释而成,待用。
孔雀石绿溶液:准确称取0.0911g孔雀石绿,用蒸馏水稀释到浓度为1×10-3mol/L,待用。
硫酸:用移液管移取3mol/L的硫酸3mL,用蒸馏水稀释为0.18mol/L,待用。
过氧化氢:由市售的30%(质量分数)用蒸馏水稀释为15%(质量分数),现配现用。
实验过程中所用试剂均为分析纯,实验用水为去离子水。
1.2 实验方法
取25mL的带塞子的比色管两支,分别依次加入2.5mL 1×10-3mol/L孔雀石绿,3.0mL 15%的过氧化氢,2.0mL 0.18mol/L硫酸,向其中一支比色管中加入适量的铬(VI),另一支不加,用水稀释至刻度线处,摇匀,然后在55℃的恒温水浴中加热7min(用秒表计时),迅速取出,用流水冷却8min,用1cm比色皿,以蒸馏水为参比,在618nm波长处,分别测量非催化体系和催化体系的吸光度A0和 A,计算A =A0–A。
2 结果与讨论
2.1 吸收光谱
按照实验方法,分别向体系中加入不同浓度铬(VI),按照上述实验方法得到催化体系和非催化体系的吸收光谱如图1所示。曲线1为非催化体系,曲线2、3、4分别为催化体系,由曲线1与曲线2、3、4对比的可看出,铬(VI)的存在使孔雀石绿体系褪色比较明显,且与加入铬(VI)的量成正比,可以说明铬(VI)的存在对过氧化氢氧化孔雀石绿的褪色反应具有明显的催化作用。在试验条件下,非催化体系和催化体系的差值A在最大吸收波长618nm处是最大的,因此该实验体系选择618nm作为本实验体系的测定波长。
图 1:体系的吸收光谱
1—2mLH2SO4+4.5mLH2O2+3.5mL孔雀石绿;
2—2mLH2SO4+4.5mLH2O2+3.5mL孔雀石绿+0.10μgCr(VI);
3—2mLH2SO4+4.5mLH2O2+3.5mL孔雀石绿+0.50μgCr(VI);
4—2mLH2SO4+4.5mLH2O2 +3.5mL孔雀石绿+1.00μgCr(VI);
2.2 测定条件的优化
2.2.1 反应酸度的影响
在其它实验变量保持不变的条件下,研究H2SO4 的用量对反应的影响,0.18mol/LH2SO4溶液的用量分别为0.5、1.0、1.5、2.0、2.5、3.0、3.5mL,结果如图2所示。当H2SO4的用量在0.5~2.0mL范围之内,A随H2SO4用量的增加而逐渐增加。当H2SO4的用量为2.0mL时,A最大。当H2SO4的用量超过2.0mL时,A随H2SO4用量的增加而逐渐降低。因此,该实验体系选择H2SO4 溶液的用量为2.0mL。
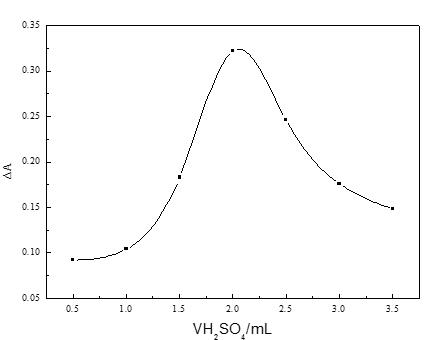
图2 反应酸度的影响
2.2.2 H2O2用量的影响
在其它实验变量保持不变的条件下,研究H2O2溶液的用量对反应的影响, 15%H2O2溶液的用量分别为1.0、1.5、2.0、2.5、3.0、3.5、4.0mL,结果如图3所示。当H2O2的用量在1.0~3.0mL范围之内,A随用量的增加而增加。当H2O2溶液的用量为3.0mL时,A最大。当H2O2的用量超过3.0mL时,A随H2O2用量的增加而逐渐随降低。因此,该反应体系选择H2O2溶液的用量为3.0mL。 催化光度法测定六价铬含量(2):http://www.youerw.com/huaxue/lunwen_35585.html

